- Содержание
- История открытий и производства [ править | править код ]
- Получение [ править | править код ]
- Применение [ править | править код ]
- Очистка и осушение [ править | править код ]
- Меры безопасности [ править | править код ]
- Первое «знакомство» с этиленгликолем и глицерином: история получения
- Строение и структура соединения
- Классификационная принадлежность
- Физические характеристики
- Методы получения
- Характеристика общих химических свойств
- Реакции с активными металлами
- Качественная реакция на этиленгликоль
- Полимеризация
- Обмен гидроксила на галоген
- Получение эфиров
- Важнейшие производные этиленгликоля
- Области применения и ценовая политика продукционного ряда
Екатеринбург 2016
Содержание
— Понятие об Спиртах
— Применение спиртов в промышленности
Введение
СПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Многоатомные спирты
Многоатомными являются спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями.
Этиленгликоль
Этиленгликоль (тривиальное название) или этандиол (систематическое название). Химическая формула HO−CH2CH2−OHHO−CH2CH2−OH.
Двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество. Температура вспышки паров 120 градусов C.
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
ПОЛУЧЕНИЕ ЭТИЛЕНГЛИКОЛЯ
В промышленности этиленгликоль получают путём:
· (I) гидратацией 1,2-дихлорэтана;
· (II) гидратацией хлоргидринов;
· (III) гидратации окиси этилена при повышенном давлении и температуре в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода;
· (IV) окислением этилена перманганатом калия:

ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Этиленгликоль обладает всеми свойствами гликолей.
1. Взаимодействие с щелочными металлами: образует соли гликоляты
 В отличие от одноатомных спиртов, многоатомные взаимодействуют также и соснованиями. Качественным реактивом на многоатомные спирты является щелочной раствор гидроксида меди(II), при взаимодействии с которым многоатомные спирты образуют комплексное соединение с медью ярко-синего цвета.
В отличие от одноатомных спиртов, многоатомные взаимодействуют также и соснованиями. Качественным реактивом на многоатомные спирты является щелочной раствор гидроксида меди(II), при взаимодействии с которым многоатомные спирты образуют комплексное соединение с медью ярко-синего цвета. 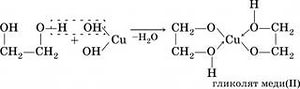
2. Взаимодействие с органическими кислотами: образует -одно- и двухзамещенные сложные эфиры (аналогично глицерину)
3. Взаимодействие с галогеноводородами HHal: образует этиленгалогенгидрины
HOCH2CH2OH+HHal⟶HOCH2CH2Hаl+H2O

4. Дегидратация при нагревании в присутствии концентрированной серной кислоты: образуется ацетальдегид 5. Окисление в зависимости от условий и окислителя: могут образовываться
· глиоксалевая и щавелевая кислоты;
Окисление молекулярным кислородом приводит к образованию формальдегида HCOH и муравьиной кислоты HCOOH.
Глицерин
Глицерин(тривиальное название) или пропантриол-1,2,3 (название по систематической номенклатуре).
Трехатомный спирт,входящий в состав сложных эфиров природного происхождения — жидких и твердых жиров.
Бесцветная вязкая жидкость, за счет наличия водородных связей смешивается с водой в любых отношениях. Безводный глицерин очень гигроскопичен, при попадании на кожу вызывает ожоги, но в разбавленном состоянии используется при изготовлении косметических средств (кремов, гелей), и даже в пищевой промышленности для приготовления ликеров.
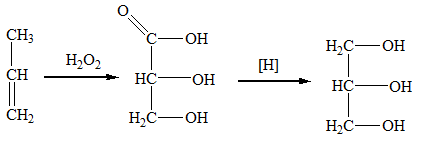
Получение глицерина
Глицерин получают гидролизом жиров, а также из пропилена (через получение 2,3-гидроксипропановой кислоты с последующим ее восстановлением):
Дата добавления: 2016-11-18 ; просмотров: 11125 | Нарушение авторских прав
| Этиленгликоль | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
этандиол-1,2 |
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Хим. формула | C2H6O2 |
| Рац. формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 62,068 г/моль |
| Плотность | 1,113 г/см³ |
| Термические свойства | |
| Т. плав. | −12,9 °C |
| Т. кип. | 197,3 °C |
| Т. всп. | 111 °C |
| Пр. взрв. | 3,2 ± 0,1 об.% [1] |
| Давление пара | 0,06 ± 0,01 мм рт.ст. [1] |
| Химические свойства | |
| pKa | 15,1 ± 0,1 [2] |
| Оптические свойства | |
| Показатель преломления | 1,4318 |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| PubChem | 174 |
| Рег. номер EINECS | 203-473-3 |
| SMILES | |
| RTECS | KW2975000 |
| ChEBI | 30742 |
| ChemSpider | 13835235 |
| Безопасность | |
| ПДК | 5 мг/м 3 |
| ЛД50 | 4700 мг/кг (крысы, перорально) |
| Токсичность |
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. [3]
Содержание
История открытий и производства [ править | править код ]
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение [ править | править код ]
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение [ править | править код ]
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона

1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [4] или комплекса диметилсульфат-ДМФА [5] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого веществанитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Очистка и осушение [ править | править код ]
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности [ править | править код ]
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен [6] [7] . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) [8] . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол [9] .
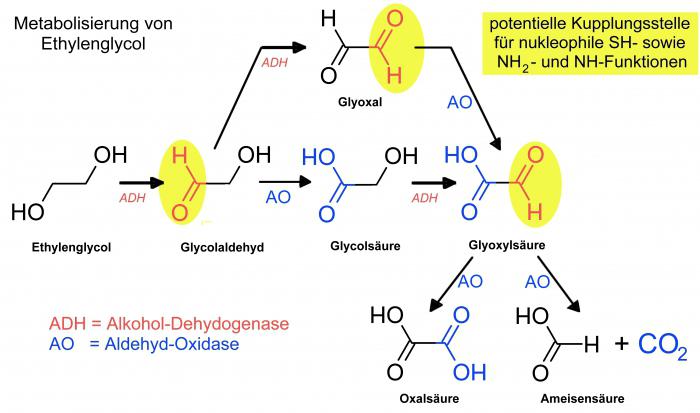
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой [10] .
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов – это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих органических соединений во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же – моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхлоргидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.

Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие транс-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Классификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано практически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Физические характеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, характерные только для данного класса органических соединений.
Самое важно из свойств – это неограниченная способность смешиваться с Н2О. Вода + этиленгликоль даёт раствор, обладающий уникальной характеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект – температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических характеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль – это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехарактерным запахом, практически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение – при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.

Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н2О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхлоргидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток – гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), хлоратом калия и др. Также существуют электрохимические и радиационно-химические методы.
Характеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных "собратьев". Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.

Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
Качественная реакция на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, характерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный гидроксид меди (2), имеющий характерный голубой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (2).
Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя – диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты – ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.

Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных химических реакций (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых — НО-СН2-СН2-О-СН3 и НО-СН2-СН2-О-С2Н5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с характерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3 ).
- Диметилэтиленгликоль – также жидкость, но с менее характерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов — так в общем называют моноэфиры этиленгликоля — довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их физические свойства для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колеблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.

Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок – не более пяти лет.
